Иоганн Глаубер

Один из самых известных алхимиков - аптекарей Иоганн-Рудольф Глаубер родился в 1604 г. в Германии. Юность его пришлась на время опустошительных религиозных войн. Годы странствий по разорённому отечеству, невзгоды, болезни — и, наконец, счастье улыбнулось настойчивому и любознательному юноше: он стал помощником нойштадтского аптекаря Айснера. За год работы Глаубер приобрёл столько опыта и знаний, что смог поступить на работу в одну из аптек в Вене. Но Тридцатилетняя война (1618—1648 гг.) продолжалась, и молодому аптекарю пришлось переехать сначала в Зальцбург, затем в Кассель, а после этого — в Париж.
В 1644 г. Глаубер, который уже стал авторитетным учёным и получил известность как один из искуснейших аптекарей своего времени, был приглашён на должность управляющего графской аптекой в Гисене. Здесь развернулся его талант химика-исследователя! Глаубер сумел получить из железного купороса весьма чистую серную кислоту, нагревая в реторте кристаллы FeSO4 • 7Н2О и отгоняя полученный продукт — «купоросное масло» (которое, как выяснилось, могло растворять не только медь, но и медные руды). Позднее, уже переехав в Амстердам, Глаубер стал использовать для получения серной кислоты также квасцы KAl(SO4)2 ∙ 12H2O и «белый витриол» — цинковый купорос ZnSO4 • 7Н2О, которые ведут себя при нагревании аналогично железному купоросу.
Глаубер разработал и способ получения азотной кислоты HNO3 взаимодействием серной кислоты с селитрой KNO3. Концентрированная азотная кислота («спиритус нитри») оказалась чрезвычайно едкой жидкостью. Она растворяла все металлы (и железо — «марс», и медь — «венеру», и серебро — «луну»), только золото («солнце») оставалось в азотной кислоте неизменным.
Глаубер владел ещё одним важным секретом — способом получения «спиритус салис» — соляной кислоты НСl из поваренной соли NaCl при действии серной кислоты. При нагревании этой смеси выделялся бесцветный удушливый газ с резким запахом (хлороводород), который при поглощении водой давал соляную кислоту. Ещё одно несомненное достижение Глаубера состоит в том, что нагреванием смеси азотной кислоты и нашатыря — хлорида аммония NH4C1 — он получил «царскую водку», т. е. смесь кислот, которая растворяет даже золото.
Переселившись в маленький городок Китцингер близ Амстердама, неутомимый алхимик-аптекарь продолжал свои изыскания и вскоре научился получать концентрированную уксусную кислоту СН3СООН из винного (этилового) спирта C2H5OH...
Иоганн - Рудольф Глаубер известен не только исследованиями способов получения кислот. На его счету и выделение знаменитой «глауберовой соли» — сульфата натрия Na2SO4 • 10 Н2О, и по-лучение множества неизвестных ранее солей — нитратов и хлоридов, выделение аммиака NH3, получение сульфата аммония (NH4)2SO4 («саль аммиак секретум глаубери»), который он использовал как минеральное удобрение в своем саду. Сохранились сведения о том, что великий аптекарь первым выделил и использовал в медицинских целях фенол С6Н5ОН (карболовую кислоту) и ряд растительных алкалоидов, успешно занимался стекловарением и разработал способы получения цветного стекла... Словом, прожив всего 66 лет, Иоганн Глаубер так много сделал для химии и химической технологии, что по праву считается великим учёным.
Глауберова соль
В 1629 г. 25-летний немецкий химик, Иоганн Глаубер, изучая состав минерального источника в Нойштадте, выделил кристаллы неизвестной соли горько-солёного вкуса. Склянку с кристаллами он передал своему другу аптекарю Айснеру. И тут произошло нечто непредвиденное: кухарка Айснера, перепутав склянку с кухонной солонкой, «посолила» суп и жаркое неизвестными кристаллами. Во время званого обеда никто из гостей не подал вида, что кушанье горчит, да и сам хозяин недоумевал по поводу необычного вкуса... Ещё больше удивился Айснер, когда после обеда и он сам, и его гости почувствовали недомогание.
Предположив, в чём тут может быть дело, Айснер на следующий день принял натощак столовую ложку соли Глаубера и вскоре убедился в её сильном слабительном действии. Он сообщил коллеге о своих наблюдениях, и тот дал неизвестным кристаллам красивое название — «salis mirabile» (в переводе с лат. — «чудесная, удивительная соль»). Позднее минерал, имеющий тот же состав, что и соль Глаубера (декагидрат суль-фата натрия Na2SO4 • 10 Н2О), назвали мирабилитом...
После истории, случившейся на обеде у Айснера, новую соль стали называть Глауберовой...
На Каспии есть залив Кара-Богаз-Гол (в переводе с туркм. — «чёрная пасть»), который называют ещё «морем белого золота». Здесь находятся богатейшие в мире запасы мирабилита. Каждый год в конце ноября, когда температура воды падает до 5-6 °С, на сушу выбрасываются тысячи тонн минерала мирабилита.
Сванте Аррениус
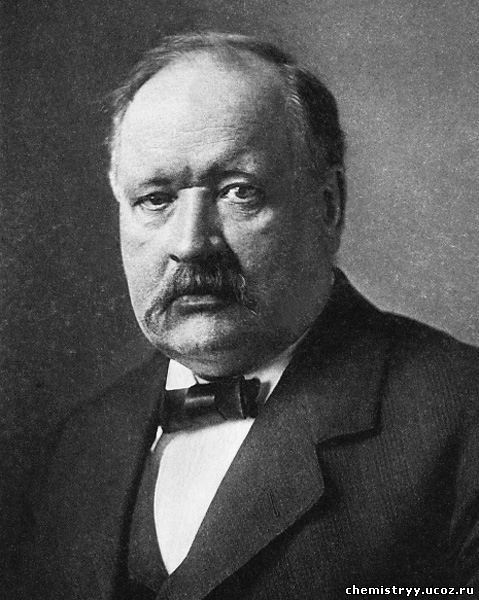
Сванте-Август Аррениус родился в 1859 г. в старинном шведском городе Упсале. В гимназии он был одним из лучших учеников. В 1859 г. Аррениуса приняли в Упсальский университет. И уже через два года (на полгода раньше срока) он сдал экзамен на степень кандидата философии. Однако впоследствии Аррениус жаловался, что обучение в университете велось по устаревшим схемам: например, «нельзя услышать ни единого слова о менделеевской системе, а ведь ей было уже больше десяти лет»...
В 1881 г. молодой учёный переехал в Стокгольм и поступил на работу в Физический
институт Академии наук. Там он приступил к изучению электрической проводимости сильно разбавленных водных растворов электролитов.
Хотя Сванте Аррениус по образованию физик, он знаменит своими химическими исследованиями и стал одним из основателей новой науки — физической химии. Особенно его занимало изучение поведения веществ-электролитов в растворах, а также исследование скорости химических реакций. Работы Аррениуса долгое время не признавались соотечественниками, и только когда выводы учёного получили высокую оценку в Германии и Франции, он был избран в Шведскую академию наук.
За разработку теории электролитической диссоциации Аррениусу была присуждена Нобелевская премия 1903 г.
Весёлый и добродушный великан Сванте Аррениус, по словам его современников, «настоящий сын шведской сельской местности», всегда был душой общества, располагал к себе коллег и просто знакомых. Учёный был дважды женат; его двух сыновей звали Олаф и Свен.
Аррениус получил широкую известность не только как физикохимик, но и как автор множества учебников, научно-популярных и просто популярных статей и книг по геофизике, астрономии, биологии и медицине.
Однако путь к мировому признанию для Аррениуса-химика оказался непростым. У теории электролитической диссоциации в учёном мире были очень серьёзные противники.
Так, Дмитрий Иванович Менделеев, русский химик, автор Периодической системы элементов, резко критиковал не только идею Аррениуса о диссоциации, но и чисто «физический» подход к пониманию природы растворов, не учитывающий химических взаимодействий между растворенным веществом и растворителем.
Впоследствии выяснилось, что и Аррениус, и Менделеев каждый по-своему правы, и их взгляды, дополняя друг друга, составили основу новой — протонной — теории кислот и оснований.
Что такое индикаторы?
Когда среда кислая, в растворе оказывается избыток катионов водорода(точнее катионов оксония Н3О ), когда щелочная – в растворе избыток гидроксидных анионов. Если в растворе катионов оксония и гидроксид-анионов поровну, то среда считается нейтральной. Катионы Н и анионы ОН непрерывно борются за первенство, а быстро определить, кто в их состязании победитель помогают «судьи» этой «олимпиады» - кислотно-основные индикаторы.
Эти вещества-указатели меняют цвет в зависимости от того, в какую среду - кислую, нейтральную или щелочную - они попали.
Причина изменения окраски заключается в том, что молекула индикатора и его ион (катион или анион), который образуется при реакции с катионами оксония ( с кислотами) или гидроксид-ионами (со щелочами), окрашены по-разному.
Вообще-то кислотно-основных индикаторов великое множество, но наиболее распространены лакмус, фенолфталеин и метилоранж.
Самым первым появился кислотно-основной индикатор лакмус. Это водный настой лакмусового лишайника, растущего на скалах в Шотландии. Этот индикатор случайно открыл в 1663 г. Английский химик и физик Роберт Бойль. Позднее настоем лакмуса стали пропитывать фильтровальную бумагу; ее высушивали и получали таким способом индикаторные «лакмусовые бумажки». Они приобретали синий цвет в щелочном растворе и красный – в кислом.
Фенолфталеин, который применяется в виде спиртового раствора, становится в щелочной среде малиновым, а в нейтральной и кислой он бесцветен. Индикатор метилоранж, или, иначе, «метиловый оранжевый», действительно имеет такой цвет в нейтральной среде. В кислотах его окраска розово-малиновая, а в щелочах – желтая.
Если нет настоящих химических индикаторов, можно успешно применять для определения кислотности среды домашние, полевые и садовые цветы и даже сок многих ягод (вишни, черноплодной рябины, смородины). Розовые, малиновые или красные цветы герани, лепестки пиона или цветного горошка станут голубыми, если опустить их в щелочной раствор. Посинеет в щелочной среде сок вишни или смородины. Наоборот, в кислоте те же реактивы примут розово-красный цвет.
Растительными кислотно-основными индикаторами здесь являются красящие вещества «антоцианы». Именно они придают разнообразные оттенки многим цветкам и плодам.
Дмитрий Иванович Менделеев

русский химик, педагог, разносторонний ученый. Оставил свыше 500 печатных трудов, среди которых классические "Основы химии" — первое стройное изложение неорганической химии. Автор фундаментальных исследований по химии, химической технологии, физике, метеорологии, воздухоплаванию, сельскому хозяйству, народному просвещению и др.
6 марта 1869 года на заседании Русского физико-химического общества профессор Н. А. Меншуткин прочитал доклад Менделеева "Опыт системы элементов, основанной на их атомном весе и химическом сродстве". Это была самая первая формулировка всемирно известного Периодического закона, окончательная редакция которого вышла в 1869-1870 годах.
Существует легенда, что впервые периодическую таблицу Менделеев увидел во сне. Именно тогда ему удалось свести воедино все наблюдения, над формированием которых он работал годы. Вот в чем состояла суть этих наблюдений. Прежде всего, свойства элементов, размещенных в ряд по весу их атомов, через более или менее равные промежутки повторяются. Так, например, в таком строю элементов на втором месте стоит литий. Литий — это легкий, так называемый щелочной металл. Ближайший сходный с ним по этому принципу — натрий — тоже легкий металл — отдален от лития на семь совсем не схожих с ними элементов. Потом калий,медь, рубидий, серебро, цезий, золото и франций. Все они повторяются через определенный промежуток, или период, и их можно объединить в одну группу. Менделеев предположил, что эти повторения не случайны, и потом смог подтвердить эту гипотезу фактами: если начинать счет с третьего по порядку элемента бериллия, оказывается, что в строю элементов встречаются и его явные родственники, причем на такой же дистанции.
Но не сразу Менделееву удалось так просто расставить все элементы в семь строк и восемь столбцов. Работа над таблицей продолжалась несколько лет. Потом, через десятилетия после смерти ученого были открыты новые химические элементы, но Менделеев знал о них. Для них он оставил в своей таблице пустые места и знаки вопроса.

Также Дмитрий Иванович Менделеев заложил основы теории растворов, предложил промышленный способ фракционного разделения нефти, изобрел вид бездымного пороха, пропагандировал использование минеральных удобрений, орошение засушливых земель.
Д.И. Менделеев — один из инициаторов создания Русского химического общества (1868 г.). Будучи профессором Петербургского университета (1865-90 гг.) ушел в отставку в знак протеста против притеснения студенчества. С 1876 года — член-корреспондент Петербургской академии наук, а с 1880 г. выдвигался в академики, но не был забаллотирован, что вызвало резкий общественный протест. Организатор и первый директор (1893 г.) Главной палаты мер и весов.
20 января 1907 года около 5 часов утра Менделеев скончался. Последние слова, написанные им в неоконченной рукописи "К познанию России", были: "В заключение считаю необходимым, хоть в самых общих чертах высказать…"
